ISOMERIA
Isomeria é o ramo da Química que estuda os compostos
diferentes que apresentam a mesma formula molecular.
ISO =
igual MEROS= partes
São dois compostos com a mesma fórmula molecular C4H8O2, porém são substâncias completamente
diferentes. Nesse caso, isomeria de função como será visto a seguir.
Este esquema mostra como a Isomeria pode ser dividida
Isomeria
Plana
Os compostos são identificados por meio de suas fórmulas
estruturais planas.
Isomeria
de posição
Apresentam o mesmo tipo de cadeia, diferindo apenas pela posição
das ramificações, insaturações ou grupos funcionais.
Isomeria
de Cadeia
Isômero que pertence à mesma função com tipo diferente de
cadeia carbônica
Isomeria
de Função
Ocorre quando os isômeros pertencem a funções diferentes
Isomeria
de Compensação ou Metameria
Ocorre quando os
isômeros pertencem à mesma função, mas diferem na posição de um heteroátomo
como o O ou N na cadeia.
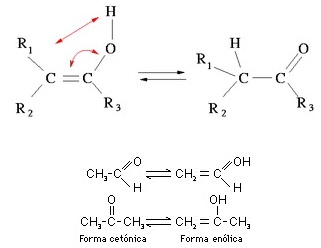
Tautomeria
É um caso especial de isomeria plana em que os compostos
pertencentes a funções químicas diferentes estabelecem um equilíbrio químico
dinâmico sem que um aldeído ou cetona transforma-se em enol ou vice versa.
Enol
é um composto instável que apresenta hidroxila presa a carbono com dupla
ligação
Observação:
Os enóis existem em solução com um aldeído ou cetona.
Sempre que tivermos uma dessas substancias no estado liquido num recipiente,
moléculas de enol, em menor quantidade, estarão presentes.
Num volume de acetona há 93% de propanona e 7% de
prop2enol.
Num volume de formol há 88% de etanol e 12% de etenol.
Isomeria
Geométrica ou CIS-TRANS
É o tipo de isomeria na qual um par de isômeros apresenta
a mesma formula molecular, mas são diferenciados em suas formulas estruturais.
Pode ocorrer em compostos com dupla ligação ou cíclicos.
- Isomeria geométrica em compostos com dupla ligação
Na primeira imagem os átomos de Cl estão do mesmo lado (CIS),
enquanto na segunda, os átomos de Cl
estão em lados opostos (TRANS).
- Isomeria
geométrica em compostos de cadeia cíclica
Isomeria
Óptica
É a isomeria que apresenta carbono com quatro ligantes
diferentes entre si.
Esse carbono é
destacado por um asterisco(*) e recebe o nome de carbono assimétrico.
Outro exemplo, ácido láctico
Assista ao vídeo abaixo e perceba melhor essas diferenças
A letra D
representa a palavra destrógiro
(para a direita) e L representa a
palavra levógiro (para a esquerda).
Neste vídeo abaixo, em espanhol é mostrado como as ondas eletromagnéticas componentes da luz, se comportam quando polarizadas e posteriormente são colocadas as soluções Dextrógira e Levógira. Repare no desvio da luz para a direita e para a esquerda.
Qualquer dúvida, pergunte nas aulas.















Nenhum comentário:
Postar um comentário